实验目的:
理解中和滴定的原理;
掌握酸碱中和滴定的操作步骤;
掌握酸碱中和反应数据的处理方法。
实验仪器和试剂:
酸式滴定管、碱式滴定管、移液管、铁架台、滴定管夹、烧杯、锥形瓶、胶头滴管。
0.100 0 mol/L 标准HCl溶液、约为0.1mol/L的NaOH溶液、酚酞溶液、甲基橙溶液、蒸馏水。
实验原理:
1、酸与碱按一定的定量关系进行反应:
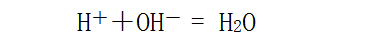
2、酸碱指示剂的颜色改变能比较准确的判断滴定终点。
实验步骤:
一、滴定管
1.滴定管的结构
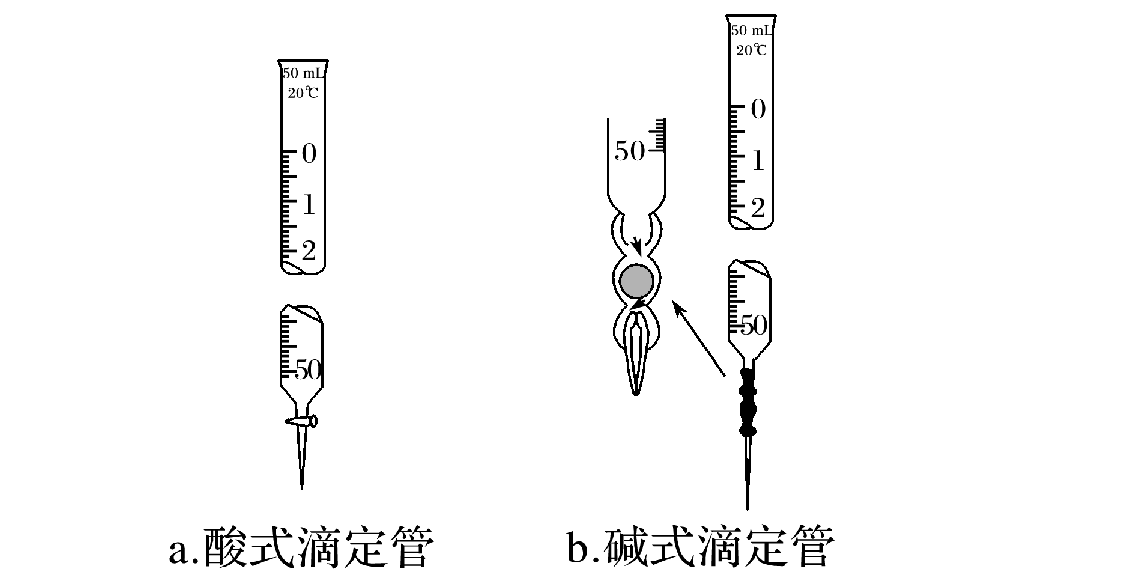
两种滴定管
酸式滴定管下端是玻璃活塞,可用于盛装酸性、中性、氧化性溶液,如,盐酸、乙醇、高锰酸钾溶液、溴水等。
碱式滴定管下端是一段橡胶管,中间有一个玻璃球,可用于盛装碱性、中性溶液,如,氢氧化钠溶液、碳酸钠溶液等。
精度为0.01 mL,0刻度在上,大刻度在下(25mL或50mL),标有使用温度25℃。
2.滴定管的使用方法
检漏:在使用前,首先要检查活塞(或橡胶管)是否漏水。
润洗:先用蒸馏水清洗后,再从滴定管上口加入适量待盛装的液体,转动滴定管,使液体润湿滴定管内壁,然后将液体放入烧杯中。
装入待装的液体:将酸或碱分别加到酸式滴定管或碱式滴定管中,使液面位于滴定管“0”刻度以上,并将滴定管垂直固定在滴定管夹上。

滴定管的固定
调节液面:控制活塞,使液面处于“0”或“0”以下的某刻度,并使滴定管尖嘴部分充满液体,准确记录读数。
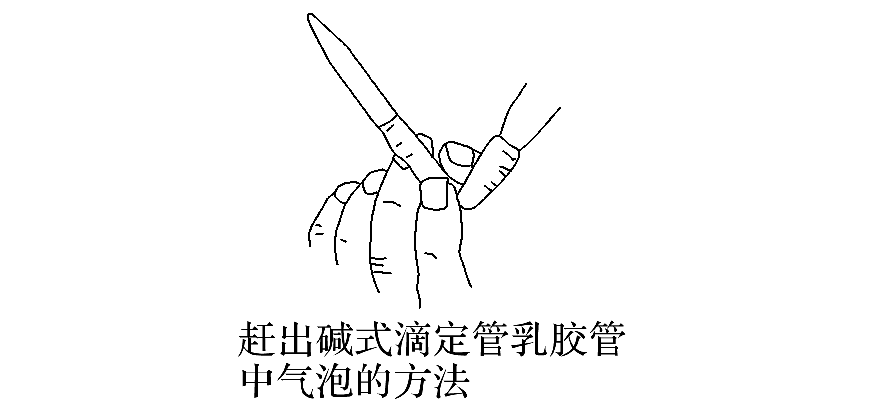
二、酸碱中和滴定的操作方法:
以用0.100 0 mol/L 标准HCl溶液滴定未知浓度的NaOH溶液为例。
1、向酸式滴定管中加入0.100 0 mol/L HCl溶液,调节液面至“0”或“0”以下的某刻度,记录准确读数,并填入表中。
2、向碱式滴定管中加入未知浓度的NaOH溶液,调节液面至“0”或“0”以下的某刻度,向锥形瓶中加入25.00 mL待测溶液(或用移液管向锥形瓶加入),再向其中滴加2滴酚酞(或甲基橙)溶液,这时溶液呈红色(或黄色)。
3、把锥形瓶放在酸式滴定管的下方,垫一张白纸,小心地滴入盐酸。边滴边摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化。直到加入半滴盐酸后,溶液由浅红色刚好变无色(或黄色变橙色),且半分钟内不变色。记录滴定管液面的读数,并填入表中。
4、重复实验两次,并记录相关数据,填入表中。
滴定次数 | 待测NaOH溶液的体积/mL | HCl溶液 |
滴定前的刻度/mL | 滴定后的刻度/mL | 体积/mL |
1 |
|
|
|
|
2 |
|
|
|
|
3 |
|
|
|
|
5、计算待测NaOH溶液的物质的量浓度。
数据处理:
c(HCl)·V(HCl)=c(NaOH)·V(NaOH)
将表中的数据分组代入计算式,求其平均值得c(NaOH)。如果某组实验数据有错误需要舍弃。